二元汽液平衡相圖(共沸)
圖(1)和圖(2)分別為T-x(y)和x-y相圖,其基本特征和普通二元相圖相似,整體由點、線和面構成。與普通相圖不同的是,其包含一個共沸點,即在該點汽相和液相對應組成相等,如兩個圖中的點C。在圖(1)中的a線,表示等溫等壓變組成的一個過程,其從左至右分別經過液相區、泡點線、汽液兩相區、露點線、汽相區、露點線、汽液兩相區、泡點線、液相區。對于具有共沸點體系,采用普通的分離方法是無法完成組分的提純的,要借助一些特殊的分離方法。圖(1)示出的為具有最低共沸點的體系,即組分混合后形成的共沸點溫度低于所有純組分的沸點;與之對應的還存在具有最高共沸點的體系,即組分混合后形成的共沸點溫度高于所有純組分的沸點。形成共沸點的根本原因是分子間力的相互作用在混合時發生了改變,使其偏離了理想行為,通常以拉烏爾定律來說明。
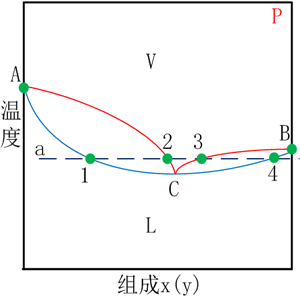
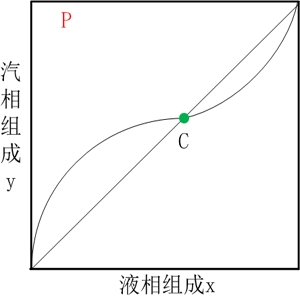
圖(1) 圖(2)
具有最低共沸點的體系:當兩個不同組分混合時,使得在相同的溫度下混合溶液上方各組分的蒸汽分壓值均高于拉烏爾定律的計算值,產生正偏差,此時混合液中不同分子間的作用力小于同種分子間作用力。該溶液在較低溫度下上方的蒸汽壓即可達到與外界相等的壓力,從而溶液沸騰,使得沸點降低。典型的例子有乙醇-水體系。
具有最高共沸點的體系:當兩個不同組分混合時,使得在相同的溫度下混合溶液上方各組分的蒸汽分壓值均低于拉烏爾定律的計算值,產生負偏差,此時混合液中不同分子間的作用力大于同種分子間作用力。該溶液在較高溫度下上方的蒸汽壓才可達到與外界相等的壓力,使得溶液沸騰,即沸點降低。典型的例子有硝酸-水體系。
理想溶液和拉烏爾定律:
理想溶液是指溶液中不同組分分子之間的作用力完全相等,且混合時無體積效應和熱效應,這是一種假設的理想化地溶液,此溶液的汽液平衡關系服從拉烏爾定律。所謂拉烏爾定律,是指在一定的溫度條件下混合溶液上方汽相中某一組分的分壓等于該溫度條件下該純組分飽和蒸汽壓與液相中該組分摩爾分率的乘積,用公式表示為:pi = pioxi。
pi ——汽相分壓;
pio——純組分飽和蒸汽壓;
xi——液相摩爾分率。
